Toll受体信号通路是昆虫应对病原体感染的重要先天免疫反应,其细胞外信号转导涉及丝氨酸蛋白酶级联激活。然而,该通路的过度或组成性激活对昆虫是不利的。先前的研究表明,丝氨酸蛋白酶抑制剂serpins通过抑制细胞外蛋白酶级联信号传导来负调控昆虫先天免疫。尽管serpin在昆虫先天免疫中的作用已有较多研究,但其协同作用的生理机制仍知之甚少。
近日,种质创制大科学中心家蚕团队赵萍教授课题组在PLOS pathogens发表题为“Serpin-1a and serpin-6 regulate the Toll pathway immune homeostasis by synergistically inhibiting the Spätzle-processing enzyme CLIP2 in silkworm, Bombyx mori”的研究论文,揭示了家蚕serpin-1a和serpin-6协同调节Toll通路免疫稳态的分子机制。
该研究发现,丝氨酸蛋白酶CLIP2作为家蚕Toll通路的细胞外末端蛋白酶发挥作用,通过加工胞外配体proSpätzle1来促进抗菌肽基因的表达,并增强血淋巴的抗菌活性。通过与CLIP2形成共价复合物,家蚕serpin-1a和serpin-6在生理或病理条件下协同靶向血淋巴中的CLIP2。此外,在没有免疫刺激的情况下,敲除serpin-1增加了CLIP2的丰度和抗菌肽的本底表达水平。然而,敲除serpin-1后的免疫刺激引起serpin-6的补偿性表达,进而导致敲除个体中抗菌肽的表达水平及其对病原菌的抵抗力与野生型个体接近。这些结果证实,家蚕血淋巴组成型serpin-1a和诱导型serpin-6协同调节CLIP2的活性,以维持生理和病理条件下家蚕Toll通路的免疫稳态。
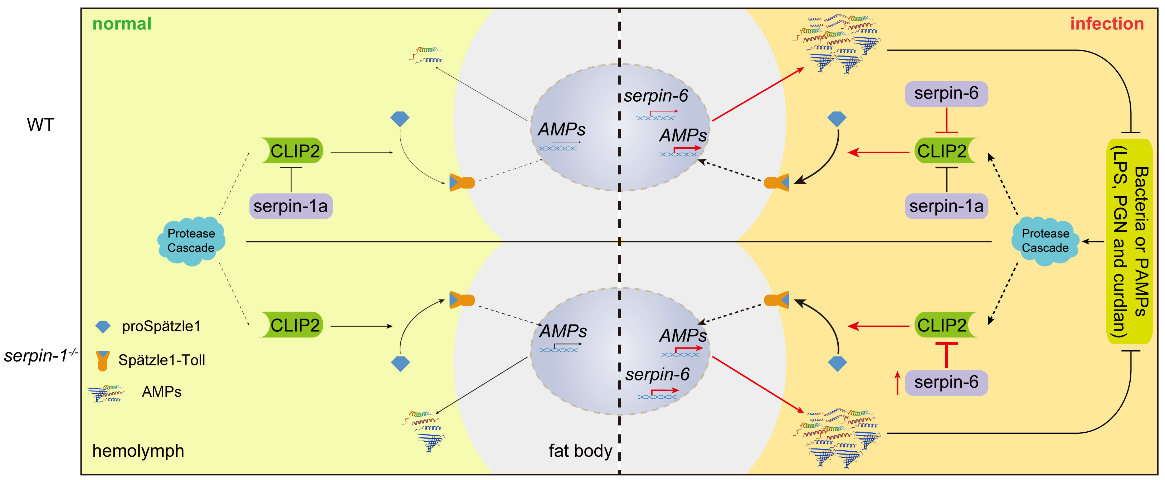
该研究为昆虫先天免疫反应中Toll级联激活信号的精确调节提供了新的见解,并强调了昆虫免疫稳态调节的重要性和复杂性,也为家蚕抗病素材创制提供了理论基础和新靶点。
家蚕创制团队青年教师刘华伟和硕士研究生徐佳卉为论文共同第一作者,赵萍教授为论文通讯作者。本研究得到了国家自然科学基金、国家重点研发计划、中央高校基本科研业务费等项目的支持。
原文链接:https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1011740